Окислительно-восстановительные и электрохимические реакции : Определение и примеры вопросов
Окислительно-восстановительные и электрохимические реакции

Понимание
Химические реакции можно разделить на различные типы реакций.. Один из них — реакция, связанная с изменением степени окисления атомов до или после реакции..
Из обзора степеней окисления реакции можно разделить на: 2 тип т.е. :
Группа реакций, в которых участвующие атомы не меняют свою степень окисления ни до, ни после реакции.. Реакции, в которых участвующие атомы не испытывают изменения степени окисления, называются неокислительно-восстановительными реакциями, которые обычно называют неокислительно-восстановительная реакция.
Группа реакций, в которых участвующие атомы претерпевают изменение степени окисления.. До и после реакции степени окисления участвующих атомов не одинаковы. (измененный). Эта реакция называется окислительно-восстановительной реакцией. (окислительно-восстановительные реакции)
Понимание окислительно-восстановительных реакций
Редокс (Снижение окисления). Восстановление – это прирост электронов или уменьшение степени окисления., в то время как окисление - это выделение электронов или увеличение степени окисления
Пример Реакция восстановления
Cu2+(ак) + 2е ® Cu (с) Ag+(ак) + е ® Аг(с)
Пример Реакция окисления
Зн(с) ® Zn2+(ак)+ 2и Ал(с) ® Ал3+(ак) + 3е
Правила определения степени окисления :
- Атомы в элементе имеют степень окисления, равную нулю.
- Атом H в соединении имеет степень окисления +1
- Гидриды металлов (например NaH, BaH2, AlH3) Степень окисления H такая же, как -1
- соединение F2O, степень окисления О = +2
- В перекиси (H2O2, Na2O2, БаО2) Степень окисления О такая же, как -1
- Атомы металлов в соединениях имеют положительную степень окисления.
- Полная степень окисления атомов в соединении равна нулю.
- Сумма степеней окисления атомов иона равна заряду иона.
- Если два атома связаны, Отрицательные степени окисления всегда принадлежат атомам, электроотрицательность которых имеет тенденцию быть больше.
Основные понятия Redox
- Окисление — это процесс высвобождения электронов или увеличения степени окисления.
- Восстановление – это процесс захвата электронов или уменьшения степени окисления.
- Редуктор (редуктор) это вещество, которое подвергается окислению или вещество, которое высвобождает электроны, или вещества, степени окисления которых имеют тенденцию к увеличению
- Окислители – это вещества, которые подвергаются восстановлению или вещества, захватывающие электроны. / вещества, степень окисления которых снижается
- Redox — это реакция, состоящая из процессов восстановления и окисления, или реакция изменения степени окисления.
- Реакция диспропорционирования (авторедоксы) это окислительно-восстановительная реакция, при которой только один тип атомов подвергается восстановлению и окислению, или окислительно-восстановительная реакция, при которой только один тип атомов меняет степень окисления
- Моли электронов – это разница степеней окисления
Метод определения числа окисления
Этапы балансировки реакции :
- Определите, какие элементы подвергаются окислению и восстановлению, на основе изменения степени окисления каждого элемента.
- Сбалансируйте количество элементов, испытывающих окислительно-восстановительный потенциал, добавив соответствующие коэффициенты.
- Определяет величину увеличения или уменьшения степени окисления элемента, у которого изменяется степень окисления.
- Сбалансируйте изменения степеней окисления, предоставив соответствующие коэффициенты.
- Балансировка количества атомов H и O и других элементов
Метод полуреакции
Шаг балансировки реакции:
Напишите только вещества, вступающие в окислительно-восстановительные реакции.
Разделите реакцию на две части, полуреакция восстановления и полуреакция окисления
Балансировка атомов, подвергающихся окислительно-восстановительному воздействию, кроме атома водорода (ЧАС) и кислород (О)
Сбалансируйте атомы кислорода, добавив молекулы H2O в участок, в котором не хватает кислорода.
Балансируйте атомы водорода, добавляя ионы H+ к той стороне, где отсутствуют атомы H.
Балансировка зарядов путем добавления электронов на сторону, имеющую более положительный заряд.
Приравняйте количество электронов с помощью уравнений полуреакции восстановления и окисления.
Соединение двух уравнений полуреакции для формирования полной окислительно-восстановительной реакции.
Отдача в виде первоначальных реакций
Понимание электрохимических ячеек
Перенос электрона в окислительно-восстановительных реакциях в растворе происходит путем прямого контакта между частицами в виде атомов. , молекулы или ионы, которые передают электроны друг другу.
Электрохимическая ячейка — это ячейка или место, где происходит поток электронов, вызванный преобразованием химической энергии в электрическую или наоборот.. Эти клетки делятся на два типа, а именно: :
- Сель Вольта
- Электролизная ячейка
В гальванических элементах химическая энергия преобразуется в электрическую, а в электролитических элементах электрическая энергия превращается в химическую.. Как происходит процесс??
Сель Вольта
Сель Вольта воспользоваться спонтанными реакциями (∆г < 0) генерировать электрическую энергию, Разница между энергией реагентов и продуктов преобразуется в электрическую энергию.. Системы реагирования действительно воздействуют на окружающую среду
Электролизная ячейка использовать электрическую энергию для осуществления несамопроизвольных реакций (∆г > 0) рабочая среда для системы
Оба типа ячеек используют электроды., а именно вещества, которые проводят электричество между клетками и окружающей средой и погружены в электролиты (ионная смесь) те, кто участвует в реакциях или те, кто несет заряд.
Компоненты вольта-элемента
Цепи электрохимических ячеек впервые изучили Луиджи Гальвани и Алессандро Вольта. . Поэтому его называют гальваническим элементом или вольтовым элементом.. Оба открыли образование энергии в результате химических реакций.. Энергия, вырабатываемая в результате химических реакций элементов Вольта, представляет собой электрическую энергию.
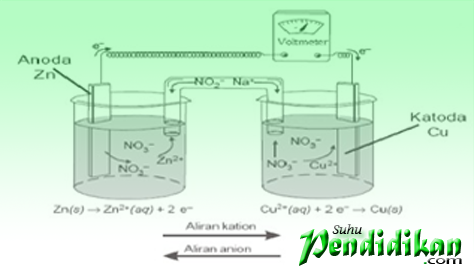
Вольта-элементы состоят из электродов. (металлический цинк & медь) раствор электролита (ZnSO4 и CuSO4), и соляной мост. Металлический цинк и медь действуют как электроды.. Оба подключены через вольтметр.. Электрод, на котором происходит окисление, называется анодом или отрицательным электродом., а электрод, на котором происходит восстановление, называется катодом или положительным электродом.
Обозначение вольтовой ячейки
•Вольтовы элементы обозначаются согласованным образом. (для ячеек Zn/Cu2+)
Зн(с)|Zn2+(ак)║Cu2+(ак)|Cu(с)
Пример вопроса Redooks
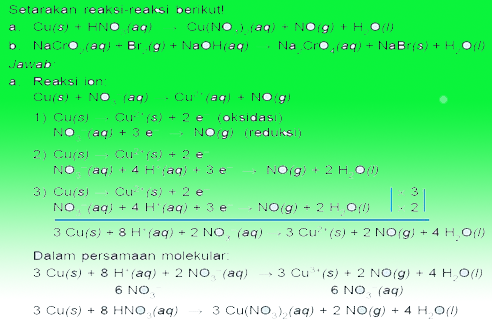
Таким образом, докладчик по окислительно-восстановительному процессу и электрохимии, Надеюсь, это полезно
Другие статьи :
- Коллигативные свойства растворов : Молярность, Моляльность и мольная доля
- Формулы геометрических рядов и примеры вопросов, касающихся геометрических рядов
- Вирус : Состав, Классификация, Форма, История, определение и примеры вирусов
Пост-окислительно-восстановительные и электрохимические реакции : Вопросы-определения и примеры впервые появились на этой странице..