Redoks og elektrokjemiske reaksjoner : Definisjon og eksempelspørsmål
Redoks og elektrokjemiske reaksjoner

Forståelse
Kjemiske reaksjoner kan deles inn i ulike typer reaksjoner. En av dem er en reaksjon relatert til endringer i oksidasjonstallet til atomer før eller etter reaksjonen.
Fra en gjennomgang av oksidasjonstall kan reaksjoner deles inn i: 2 type dvs :
En gruppe reaksjoner der de involverte atomene ikke endrer oksidasjonstallet før eller etter reaksjonen. Reaksjoner der de involverte atomene ikke opplever en endring i oksidasjonstall kalles ikke-oksidasjons-reduksjonsreaksjoner som vanligvis kalles ikke-redoksreaksjon.
En gruppe reaksjoner der de involverte atomene gjennomgår en endring i oksidasjonsnummer. Før og etter reaksjonen er oksidasjonstallene til de involverte atomene ikke de samme (endret). Denne reaksjonen kalles en oksidasjons-reduksjonsreaksjon (redoksreaksjoner)
Forstå redoksreaksjoner
Redoks (oksidasjonsreduksjon). Reduksjon er forsterkningen av elektroner eller en reduksjon i oksidasjonstallet, mens oksidasjon er frigjøring av elektroner eller en økning i oksidasjonstallet
Eksempel Reduksjonsreaksjon
Cu2+(En q) + 2e ® Cu (s) Ag+(En q) + e ® Ag(s)
Eksempel Oksidasjonsreaksjon
Zn(s) ® Zn2+(En q)+ 2og Al(s) ® Al3+(En q) + 3e
Regler for å bestemme oksidasjonstall :
- Atomer i et grunnstoff har et oksidasjonstall på null
- H-atomet i forbindelsen har et oksidasjonsnummer +1
- Metallhydrider (for eksempel NaH, BaH2, AlH3) Oksydasjonstallet til H er det samme som -1
- F2O-forbindelse, oksidasjonstall O = +2
- I peroksid (H2O2, Na2O2, BaO2) Oksydasjonstallet til O er det samme som -1
- Metallatomer i forbindelser har et positivt oksidasjonstall
- Det totale oksidasjonsantallet av atomer i en forbindelse er null
- Summen av oksidasjonstallene til atomene i et ion er lik ionets ladning
- Hvis to atomer binder seg, Negative oksidasjonstall tilhører alltid atomer hvis elektronegativitet har en tendens til å være større
Grunnleggende konsepter for Redox
- Oksidasjon er tilfelle av frigjøring av elektroner eller tilsetning av oksidasjonstall
- Reduksjon er hendelsen av å fange elektroner eller redusere oksidasjonstallet
- Reduser (redusering) er et stoff som gjennomgår oksidasjon eller et stoff som frigjør elektroner, eller stoffer hvis oksidasjonstall har en tendens til å øke
- Oksidasjonsmidler er stoffer som gjennomgår reduksjon eller stoffer som fanger opp elektroner / stoffer hvis oksidasjonstall synker
- Redoks er en reaksjon som består av reduksjons- og oksidasjonshendelser eller en reaksjon for å endre oksidasjonstallet
- Uforholdsmessig reaksjon (autoredoks) er en redoksreaksjon hvor bare én type atom gjennomgår reduksjon og oksidasjon eller en redoksreaksjon hvor bare én type atom har endret oksidasjonsnummer
- Mol av elektroner er forskjellen i oksidasjonstall
Oksidasjonsnummermetode
Reaksjonsbalanserende trinn :
- Bestem hvilke grunnstoffer som gjennomgår oksidasjon og reduksjon basert på endringer i oksidasjonstallet til hvert element
- Balanser antall elementer som opplever redoks ved å legge til de riktige koeffisientene
- Bestemmer størrelsen på økningen eller reduksjonen i oksidasjonstallet til elementet som opplever en endring i oksidasjonstallet
- Balanser endringer i oksidasjonstall ved å gi passende koeffisienter
- Balansering av antall H- og O-atomer og andre grunnstoffer
Halvreaksjonsmetode
Reaksjonsbalanseringstrinn:
Skriv kun stoffer som gjennomgår redoksreaksjoner
Del reaksjonen i to, reduksjonshalvreaksjon og oksidasjonshalvreaksjon
Balansere atomene som gjennomgår redoks, bortsett fra hydrogenatomer (H) og oksygen (O)
Balanser oksygenatomer ved å tilsette H2O-molekyler til seksjonen som mangler oksygen
Balanser hydrogenatomer ved å legge til H+-ioner til siden som mangler H-atomer
Balansere ladninger ved å legge til elektroner på siden som har en mer positiv ladning
Lik antall elektroner med halvreaksjonsligninger for både reduksjon og oksidasjon
Sette sammen de to halvreaksjonsligningene for å danne en fullstendig redoksreaksjon
Returnerer i form av innledende reaksjoner
Forstå elektrokjemiske celler
Elektronoverføring i oppløsningsredoksreaksjoner skjer gjennom direkte kontakt mellom partikler i form av atomer , molekyler eller ioner som overfører elektroner til hverandre.
En elektrokjemisk celle er en celle eller et sted hvor strømmen av elektroner oppstår som er forårsaket av å endre kjemisk energi til elektrisk energi eller omvendt. Disse cellene er gruppert i to typer, nemlig :
- Sel Volta
- Elektrolysecelle
Voltaiske celler involverer å endre kjemisk energi til elektrisk energi, mens elektrolyseceller involverer å endre elektrisk energi til kjemisk energi. Hvordan skjer prosessen??
Sel Volta
Sel Volta dra nytte av spontane reaksjoner (∆G < 0) å generere elektrisk energi, Forskjellen mellom energien til reaktantene og produktene omdannes til elektrisk energi. Reaksjonssystemer virker på miljøet
Elektrolysecelle bruke elektrisk energi til å utføre ikke-spontane reaksjoner (∆G > 0) arbeidsmiljø for systemet
Begge typer celler bruker elektroder, nemlig stoffer som leder elektrisitet mellom celler og miljø og er nedsenket i elektrolytter (ionisk blanding) de som er involvert i reaksjoner eller de som bærer ansvaret.
Volta-cellekomponenter
Elektrokjemiske cellekretser ble først studert av Luigi Galvani og Alessandro Volta . Så det kalles en galvanisk celle eller voltaisk celle. Begge oppdaget dannelsen av energi fra kjemiske reaksjoner. Energien som produseres fra de kjemiske reaksjonene til Volta-celler er elektrisk energi
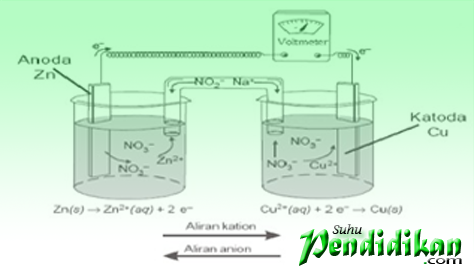
Voltaceller består av elektroder (sink metall & kobber) elektrolyttløsning (ZnSO4 og CuSO4), og saltbroen. Sink og kobbermetall fungerer som elektroder. Begge er koblet sammen via et voltmeter. Elektroden der oksidasjon finner sted kalles anode eller negativ elektrode, mens elektroden der reduksjonen finner sted kalles katoden eller positiv elektrode
Volta-cellenotasjon
•Voltaiske celler er betegnet på en avtalt måte (for Zn/Cu2+-celler)
Zn(s)|Zn2+(En q)║Cu2+(En q)|Cu(s)
Eksempel på et Redooks-spørsmål
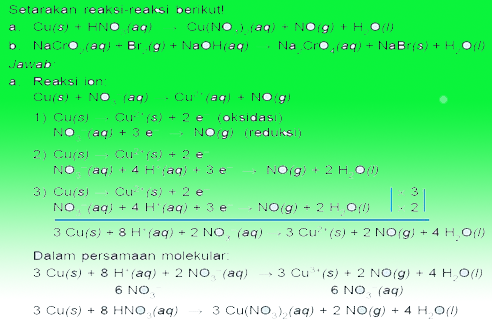
Altså taleren om redoks og elektrokjemi, Håper det er nyttig
Andre artikler :
- Kolligative egenskaper til løsninger : Molaritet, Molalitet og føflekkfraksjon
- Geometriske serieformler og eksempler på geometriske seriespørsmål
- Virus : Struktur, Klassifisering, Skjema, Historie og definisjon og eksempler på virus
Innlegget Redoks og elektrokjemiske reaksjoner : Definisjons- og eksempelspørsmål dukket opp først på denne siden.