Sifat Kolaboratif Penyelesaian : Molaritas, Molekul dan Pecahan Mol
The Colligative Properties of solution merangkumi penjelasan mengenai molalitas, Molariti dan pecahan tahi lalat

Definisi Sifat Kolaboratif Penyelesaian
"Sifat koligatif penyelesaiannya adalah." sifat larutan yang tidak bergantung pada jenis zat terlarut tetapi bergantung kepada kepekatan zarah zat terlarut”
Sifat kolaboratif penyelesaian terdiri daripada dua jenis, iaitu sifat koligatif larutan elektrolit dan juga sifat koligatif larutan bukan elektrolit
Molaritas, Molekul dan Pecahan Mol
Dalam penyelesaian, terdapat beberapa sifat bahan yang ditentukan oleh bilangan zarah zat terlarut]. Sifat koligatif larutan ditentukan oleh bilangan zarah zat terlarut, perlu mengetahui mengenai kepekatan larutan
Molaritas (M)
Molariti adalah sebilangan besar mol zat terlarut di 1 liter larutan.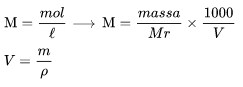
Maklumat :
M adalah molariti
Mr adalah massa molar zat terlarut
V ialah isipadu larutan,
Molalitas (m)
Molality adalah bilangan mol zat terlarut di 1 kg (1000 gram) pelarut.
Molality ditakrifkan oleh persamaan:![]()
Maklumat:
m adalah molaliti (mol / kg)
Mr adalah massa molar zat terlarut (g / mol)
jisim ialah jisim zat terlarut (g)
P ialah jisim pelarut (g)
Pecahan mol
Fraction mol adalah unit kepekatan semua komponen larutan dinyatakan dalam mol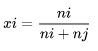
Sifat kolaboratif larutan Bukan elektrolit
Sifat kolegatif melibatkan penyelesaian, Sifat kolegatif tidak bergantung pada interaksi molekul pelarut dan zat terlarut, tetapi bergantung pada jumlah zat terlarut yang dilarutkan dalam larutan.
Sifat kolegatif terdiri daripada :
- penurunan tekanan wap
- kenaikan takat didih
- penurunan titik beku
- tekanan osmotik
Pengurangan Tekanan Wap
![]()
P0 = tekanan wap cecair tulen
P = tekanan wap larutan
Peningkatan takat didih
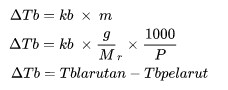
ΔTb adalah kenaikan titik didih (oC)
kb merupakan tetapan kenaikan titik didih molal
m adalah molaliti penyelesaian (mol / kg)
Encik adalah jisim molekul relatif
P ialah jumlah jisim suatu bahan (kg)
Tabel tetapan kenaikan titik didih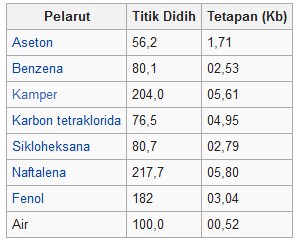
Kurangkan Titik Pembekuan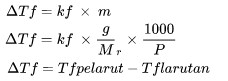
ΔTf beku (oC)
kf adalah tetapan perubahan titik beku (oC kg / mol)
m adalah molaliti penyelesaian (mol / kg)
Encik adalah jisim molekul relatif
P ialah jumlah jisim suatu bahan (kg
Tekanan osmotik
Π = M × R × T
Π adalah tekanan osmotik
M adalah molariti larutan
R adalah tetapan gas (0,082)
T adalah suhu mutlak
Sifat Kolaboratif Penyelesaian Elektrolit
Pada kepekatan yang sama, sifat koligatif larutan elektrolit mempunyai nilai yang lebih besar daripada sifat koligatif larutan bukan elektrolit. Bilangan zarah zat terlarut yang dihasilkan daripada tindak balas pengionan larutan elektrolit dirumuskan oleh faktor Van & rsquo; t Hoff
i = 1 + (n − 1) α
Maklumat :
i adalah faktor Van’t Hoff
n ialah bilangan pekali kation
α adalah tahap pengionan
Pengurangan Tekanan Wap Tepu
ΔP = P0 × X t e r l a r u t × i
Titik didih meningkat
Δ T b = k b × m × i
Kurangkan Titik Pembekuan
ΔTf = k f × m × i
Tekanan osmotik
π = M × R × T × i
Oleh itu perbincangan mengenai sifat koligatif penyelesaian, Semoga bermanfaat
Artikel lain :
- Rumusan Siri Geometri dan Contoh Masalah Siri Geometri
- Virus : Struktur, Pengelasan, Bentuk, Sejarah dan Definisi dan Contoh Virus
- Medan magnet : Perwatakan, Pemahaman dan Rumusan
The Post Colligative Properties of Solution : Molaritas, Molalitas dan Fraksi mol muncul pertama kali di halaman ini.