Reaksi Redoks dan Elektrokimia : Definisi dan Contoh Soalan
Reaksi Redoks dan Elektrokimia

Definisi
Reaksi kimia boleh dikelaskan kepada pelbagai tindak balas. Salah satunya adalah tindak balas yang berkaitan dengan perubahan bilangan pengoksidaan atom sebelum atau selepas tindak balas.
Dari tinjauan nombor pengoksidaan tindak balas dapat dibahagikan kepada 2 taip iaitu :
Kumpulan tindak balas di mana atom yang terlibat tidak mengalami perubahan bilangan pengoksidaan sebelum atau selepas tindak balas. Reaksi di mana atom yang terlibat tidak mengalami perubahan dalam bilangan pengoksidaan disebut reaksi yang tidak biasa disebut sebagai pengurangan tindak balas bukan redoks.
Golongan reaksi dimana diantara atom yang terlibat mengalami perubahan bilangan oksidasi. Sebelum maupun sesudah reaksi bilangan oksidasi atom-atom yang terlibat tidak sama (ubah). Tindak balas ini dipanggil reaksi pengurangan oksidasi (tindak balas redoks)
Memahami Reaksi Redoks
Redoks (pengurangan pengoksidaan). Pengurangan adalah penerimaan elektron atau pengurangan bilangan pengoksidaan, sementara pengoksidaan adalah pembebasan elektron atau peningkatan bilangan pengoksidaan
Contohnya Reaksi pengurangan
Cu2 +(aq) + 2e ® Dengan (s) Ag +(aq) + e ® Ag(s)
Contohnya Tindak balas pengoksidaan
Zn(s) ® Zn2 +(aq)+ 2dan Al(s) ® Al3 +(aq) + 3e
Peraturan untuk menentukan nombor pengoksidaan :
- Atom-atom dalam unsur mempunyai bilangan oksidasi nol
- Atom H dalam senyawa mempunyai bilangan oksidasi +1
- Hidrida logam (contohnya NaH, BaH2, AlH3) nombor pengoksidaan H sama dengan -1
- Sebatian F2O, nombor pengoksidaan O = +2
- Dalam peroksida (H2O2, Na2O2, BaO2) nombor pengoksidaan O sama dengan -1
- Atom logam dalam senyawa mempunyai bilangan oksidasi positif
- Bilangan nombor pengoksidaan atom dalam sebatian adalah sama dengan sifar
- Jumlah bilangan oksidasi atom-atom dalam ion sama denga muatan ion
- Sekiranya dua atom terikat, nombor pengoksidaan negatif selalu dimiliki oleh atom yang keelektronegatifannya cenderung lebih besar
Konsep asas Redox
- Pengoksidaan adalah peristiwa pembebasan elektron atau penambahan nombor pengoksidaan
- Pengurangan adalah peristiwa penangkapan elektron atau pengurangan nombor pengoksidaan
- Pengurang (agen pengurangan) adalah bahan yang mengalami pengoksidaan atau bahan yang melepaskan elektron, atau bahan yang bilangan pengoksidaannya cenderung meningkat
- Pengoksidaan adalah bahan yang dikurangkan atau bahan yang menangkap elektron / bahan yang bilangan pengoksidaannya menurun
- Redox adalah tindak balas yang terdiri daripada peristiwa pengurangan dan pengoksidaan atau reaksi perubahan nombor pengoksidaan
- Reaksi tidak seimbang (autoredoks) adalah tindak balas redoks di mana hanya satu jenis atom yang mengalami pengurangan dan pengoksidaan atau tindak balas redoks di mana hanya satu jenis atom yang bilangan pengoksidaannya berubah
- Mol elektron adalah perbezaan antara nombor pengoksidaan
Kaedah Nombor Pengoksidaan
Langkah untuk menyamakan reaksi :
- Tentukan unsur-unsur yang mengalami pengoksidaan dan pengurangan berdasarkan perubahan bilangan pengoksidaan setiap elemen
- Menyamakan bilangan elemen yang mengalami redoks dengan menambahkan pekali yang sesuai
- Tentukan jumlah kenaikan atau penurunan bilangan pengoksidaan unsur yang telah berubah dalam nombor pengoksidaan
- Mengimbangkan perubahan nombor pengoksidaan dengan memberikan pekali yang sesuai
- Mengimbangkan bilangan atom H dan O dan unsur lain
Kaedah Tindak Balas Separuh
Reaksi penyamaan langkah:
Tuliskan bahan yang mengalami reaksi redoks sahaja
Pisahkan tindak balas menjadi dua, tindak balas pengurangan separuh dan tindak balas pengoksidaan separuh
Seimbangkan atom redoks, kecuali atom hidrogen (H) dan oksigen (THE)
Seimbangkan atom oksigen dengan menambahkan molekul H2O ke segmen kekurangan oksigen
Mengimbangkan atom Hidrogen dengan menambahkan ion H + ke segmen yang kekurangan atom H
Seimbangkan cas dengan menambahkan elektron ke segmen yang mempunyai muatan yang lebih positif
Hitungkan bilangan elektron dengan dua persamaan tindak balas setengah pengurangan dan pengoksidaan
Menyatukan dua persamaan reaksi setengah untuk menjadi reaksi redoks lengkap
Mengembalikan dalam bentuk reaksi awal
Memahami Sel Elektrokimia
Pemindahan elektron dalam tindak balas redoks larutan berlaku melalui hubungan langsung antara zarah dalam bentuk atom , molekul ataupun ion yang saling serah terima elektron.
Sel elektrokimia adalah sel atau tempat di mana aliran elektron disebabkan oleh perubahan tenaga kimia menjadi tenaga elektrik atau sebaliknya. Sel-sel ini dikelompokkan menjadi dua jenis iaitu :
- Sel Volta
- Sel Elektrolisis
Sel voltan melibatkan perubahan tenaga kimia menjadi tenaga elektrik manakala sel elektrolisis melibatkan perubahan tenaga elektrik kepada tenaga kimia. Bagaimana prosesnya berlaku?
Sel Volta
Sel Volta gunakan reaksi spontan (∆G < 0) untuk menjana elektrik, perbezaan tenaga reaktan dengan produk diubah menjadi tenaga elektrik. Sistem tindak balas berfungsi pada persekitaran
Sel Elektrolisa menggunakan tenaga elektrik untuk melakukan tindak balas bukan spontan (∆G > 0) persekitaran kerja pada sistem
Kedua-dua jenis sel menggunakan elektrod, iaitu bahan yang mengalirkan elektrik antara sel dan persekitaran dan dicelupkan dalam elektrolit (campuran ion) terlibat dalam tindak balas atau membawa tuduhan.
Komponen Sel Volta
Siri sel elektrokimia pertama kali dikaji oleh Luigi Galvani dan Alessandro Volta . Jadi ia dipanggil sel Galvani atau sel Volta. Kedua-duanya menemui pembentukan tenaga daripada tindak balas kimia. Tenaga yang dihasilkan daripada tindak balas kimia sel Volta adalah tenaga elektrik
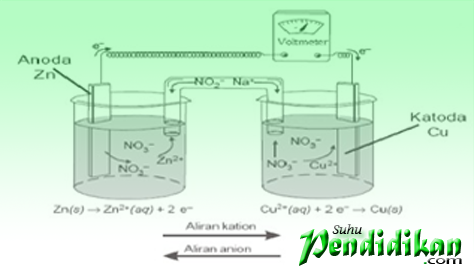
Sel voltan terdiri daripada elektrod (logam seng & tembaga) larutan elektrolit (ZnSO4 dan CuSO4), dan jambatan garam. Logam zink dan tembaga bertindak sebagai elektrod. Kedua-duanya dihubungkan melalui voltmeter. Elektrod di mana pengoksidaan berlaku disebut anod atau elektrod negatif, sedangkan elektrod di mana pengurangan disebut katod atau elektrod positif
Perhatikan Sel Volta
•Sel voltan dilambangkan dengan cara yang dipersetujui (untuk sel Zn/Cu2+)
Zn(s)|Zn2 +(aq)║Cu2 +(aq)|Dengan(s)
Contoh Soal Redooks
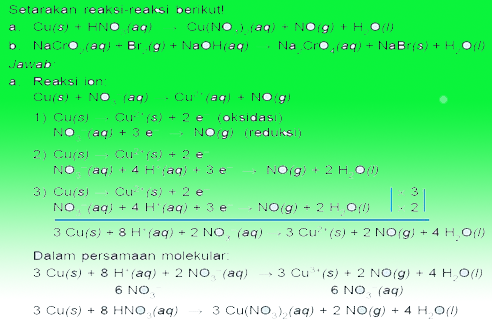
Demikianlah bahasa redoks dan elektrokimia, Semoga bermanfaat
Artikel lain :
- Sifat Kolaboratif Penyelesaian : Molaritas, Molekul dan Pecahan Mol
- Rumusan Siri Geometri dan Contoh Masalah Siri Geometri
- Virus : Struktur, Pengelasan, Bentuk, Sejarah dan Definisi dan Contoh Virus
The Reaksi Redoks dan Elektrokimia : Pengertian dan Contoh Soal muncul pertama kali di halaman ini.