Proprietà colligative delle soluzioni : Molarità, Molalità e frazione molare
Il capitolo Proprietà colligative delle soluzioni include una spiegazione della molalità, Molarità e frazione molare

Comprensione delle proprietà colligative delle soluzioni
“Le proprietà colligative delle soluzioni sono proprietà delle soluzioni che non dipendono dal tipo di soluto ma dipendono dalla concentrazione delle particelle di soluto”
Le proprietà colligative delle soluzioni sono di due tipi, vale a dire le proprietà colligative delle soluzioni elettrolitiche e anche le proprietà colligative delle soluzioni non elettrolitiche
Molarità, Molalità e frazione molare
In soluzione, Esistono diverse proprietà delle sostanze che sono determinate dal numero di particelle di soluto]. Le proprietà colligative di una soluzione sono determinate dal numero di particelle di soluto, è necessario conoscere la concentrazione della soluzione
Molarità (M)
La molarità è il numero di moli di una sostanza disciolte in una soluzione 1 litro di soluzione.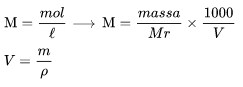
Informazione :
M è la molarità
Mr è la massa molare del soluto
V è il volume della soluzione,
Molalità (M)
La molalità è il numero di moli di soluto presenti in una soluzione 1 kg (1000 grammo) solvente.
La molalità è definita dall'equazione:![]()
Informazione:
m è la molalità (mol/kg)
Mr è la massa molare del soluto (g/mol)
la massa è la massa del soluto (G)
P è la massa del solvente (G)
Frazione molare
La frazione molare è un'unità di concentrazione di tutti i componenti della soluzione espressa in termini di moli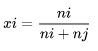
Proprietà colligative delle soluzioni non elettrolitiche
Le proprietà colligative implicano soluzioni, Le proprietà colligative non dipendono dall'interazione delle molecole di solvente e soluto, ma dipende dalla quantità di soluto disciolto in una soluzione.
Le proprietà colligative sono costituite da: :
- diminuzione della tensione di vapore
- aumento del punto di ebollizione
- depressione del punto di congelamento
- pressione osmotica
Caduta di pressione del vapore
![]()
P0 = tensione di vapore di un liquido puro
P = tensione di vapore della soluzione
Aumento del punto di ebollizione
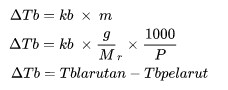
ΔTb è l'aumento del punto di ebollizione (oC)
kb è la costante di elevazione del punto di ebollizione molale
M è la molalità della soluzione (mol/kg)
Sig è la massa molecolare relativa
P è la massa della sostanza (kg)
Tabella delle costanti di elevazione del punto di ebollizione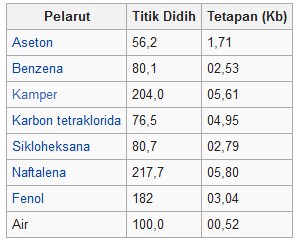
Abbassamento del punto di congelamento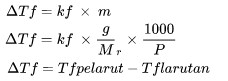
ΔTF è l'abbassamento del punto di congelamento (oC)
kf è l'impostazione per la modifica del punto di congelamento (oC kg/mol)
M è la molalità della soluzione (mol/kg)
Sig è la massa molecolare relativa
P è la massa della sostanza (kg
Pressione osmotica
Π =M × R × T
Π è la pressione osmotica
M è la molarità della soluzione
R è l'impostazione del gas (0,082)
T è la temperatura assoluta
Proprietà colligative delle soluzioni elettrolitiche
Alla stessa concentrazione, Le proprietà colligative delle soluzioni elettrolitiche hanno un valore maggiore rispetto alle proprietà colligative delle soluzioni non elettrolitiche. Il numero di particelle di soluto risultanti dalla reazione di ionizzazione della soluzione elettrolitica è formulato dal fattore Van't Hoff
io = 1 + (N − 1) α
Informazione :
i è il fattore Van't Hoff
n è il numero di coefficienti cationici
α è il grado di ionizzazione
Diminuzione della pressione del vapore saturo
ΔP = P0 × X t e r l a r u t × io
Innalzamento del punto di ebollizione
Δ Tb = kb × M × io
Abbassamento del punto di congelamento
ΔTf = kf × M × io
Pressione osmotica
π =M × R × T × io
Da qui la discussione sulle proprietà colligative delle soluzioni, Spero che sia utile
Altri articoli :
- Formule delle serie geometriche ed esempi di domande sulle serie geometriche
- Virus : Struttura, Classificazione, Modulo, Storia, definizione ed esempi di virus
- Campo magnetico : Natura, Definizione e formula
Le proprietà post colligative delle soluzioni : Molarità, Molalità e frazione molare sono apparse per prime in questa pagina.