Reazioni redox ed elettrochimiche : Definizione e domande di esempio
Reazioni redox ed elettrochimiche

Comprensione
Reaksi kimia bisa digolongkan menjadi berbagai macam reaksi. Uno di questi è una reazione legata ai cambiamenti nel numero di ossidazione degli atomi prima o dopo la reazione.
Da una revisione dei numeri di ossidazione, le reazioni possono essere suddivise in: 2 digitare ad es :
Golongan reaksi dimana atom yang terlibat tidak mengalami perubahan bilangan oksidasi sebelum maupun sesudah reaksi. Reaksi dimana atom-atom yang terlibat tidak mengalami perubahan bilangan oksidasi disebut reaksi bukan reduksi-oksidasi yang umum disebut reaksi bukan redoks.
Golongan reaksi dimana diantara atom yang terlibat mengalami perubahan bilangan oksidasi. Sebelum maupun sesudah reaksi bilangan oksidasi atom-atom yang terlibat tidak sama (berubah). Reaksi ini disebut reaksi reduksi-oksidasi (reaksi redoks)
Pengertian Reaksi Redoks
Redoks (reduksi oksidasi). Reduksi merupakan penerimaan elektron ataupun penurunan bilangan oksidasi, sedangkan oksidasi yaitu pelepasan elektron atau peningkatan bilangan oksidasi
Esempio Reaksi Reduksi
Cu2+(aq) + 2e ® Cu (s) Ag+(aq) + e ® Ag(s)
Esempio Reaksi Oksidasi
Zn(s) ® Zn2+(aq)+ 2e Al(s) ® Al3+(aq) + 3e
Aturan-aturan penentuan bilangan oksidasi :
- Atom-atom dalam unsur mempunyai bilangan oksidasi nol
- Atom H dalam senyawa mempunyai bilangan oksidasi +1
- Hidrida logam (misal NaH, BaH2, AlH3) bilangan oksidasi H sama dengan -1
- Senyawa F2O, bilangan oksidasi O = +2
- Dalam peroksida (H2O2, Na2O2, BaO2) bilangan oksidasi O sama dengan -1
- Atom logam dalam senyawa mempunyai bilangan oksidasi positif
- Jumlah bilangan oksidasi atom dalam senyawa sama dengan Nol
- Jumlah bilangan oksidasi atom-atom dalam ion sama denga muatan ion
- Jika dua atom berikatan, bilangan oksidasi negatif selalu dimiliki atom yang keelektronegatifannya cenderung lebih besar
Konsep dasar Redoks
- Oksidasi merupakan peristiwa pelepasan elektron atau penambahan bilangan oksidasi
- Reduksi yaitu peristiwa penangkapan elektron atau pengurangan bilangan oksidasi
- Reduktor (pereduksi) merupakan zat yang mengalami oksidasi atau zat yang melepaskan elektron, atau zat yang bilangan oksidasinya cenderung naik
- Oksidator merupakan zat yang mengalami reduksi atau zat yang menangkap elektron / zat yang bilangan oksidasinya turun
- Redoks yaitu reaksi yang terdiri dari peristiwa reduksi dan oksidasi atau reaksi perubahan bilangan oksidasi
- Reaksi disproporsionasi (autoredoks) merupakan reaksi redoks dimana hanya satu jenis atom yang mengalami reduksi dan oksidasi atau reaksi redoks yang hanya satu jenis atom yang bilangan oksidasinya berubah
- Mol elektron yaitu selisih bilangan oksidasi
Metode Bilangan Oksidasi
Langkah-langkah penyetaraan reaksi :
- Menentukan unsur yang mengalami oksidasi dan reduksi berdasar perubahan bilangan oksidasi setiap unsur
- Menyetarakan jumlah unsur yang mengalami redoks dengan menambahkan koefisien yang sesuai
- Menentukan besarnya kenaikan ataupun penurunan bilangan oksidasi dari unsur yang mengalami perubahan bilangan oksidasi
- Meneyetarakan perubahan bilangan oksidasi dengan memberikan koefisien yang sesuai
- Menyetarakan jumlah atom H dan O serta unsur yang lain
Metode Setengah Reaksi
Langkah penyetaraan reaksi:
Menuliskan zat yang mengalami reaksi redoks saja
Memisahkan reaksi menjadi dua, setengah reaksi reduksi dan setengah reaksi oksidasi
Menyetarakan atom yang mengalami redoks, terkecuali atom hydrogen (H) dan oksigen (O)
Menyetarakan atom oksigen dengan cara menambahkan molekul H2O ke ruas yang kekurangan oksigen
Menyetarakan atom Hidrogen dengan cara menambahkan ion H+ ke ruas yang kekurangan atom H
Menyetarakan muatan dengan cara menambahkan elektron ke ruas yang memiliki muatan lebih positif
Menyamakan jumlah elektron dengan kedua persamaan setengah reaksi reduksi dan oksidasi
Menyatukan kedua persamaan setengah reaksi hingga menjadi reaksi redoks yang utuh
Mengembalikan dalam bentuk reaksi awal
Pengertian Sel Elektrokimia
Transfer elektron pada reaksi redoks larutan berlangsung melalui kontak langsung antara partikel berupa atom , molekul ataupun ion yang saling serah terima elektron.
Sel elektrokimia merupakan suatu sel atau tempat terjadinya aliran elektron yang disebabkan oleh perubahan energi kimia menjadi energi listrik atau sebaliknya. Sel ini dikelompokkan menjadi dua macam yaitu :
- Sel Volta
- Sel Elektrolisis
Sel Volta melibatkan perubahan energi kimia menjadi energi listrik sedangkan sel elektrolisis melibatkan perubahan energi listrik hingga menjadi energi kimia. Bagaimanakah proses terjadinya?
Sel Volta
Sel Volta memanfaatkan reaksi spontan (∆G < 0) untuk membangkitkan energi listrik, selisih energi reaktan dengan produk diubah menjadi energi listrik. Sistem reaksi melakukan kerja terhadap lingkungan
Sel Elektrolisa memanfaatkan energi listrik untuk menjalankan reaksi non spontan (∆G > 0) lingkungan kerja terhadap sistem
Kedua tipe sel memakai elektroda, yaitu zat yang menghantarkan listrik antara sel dan lingkungan dan dicelupkan dalam elektrolit (campuran ion) yang terlibat di dalam reaksi atau yang membawa muatan.
Komponen Sel Volta
Rangkaian sel elektrokimia pertama kali dipelajari Luigi Galvani dan Alessandro Volta . Sehingga disebut sel Galvani atau pun sel Volta. Keduanya menemukan adanya pembentukan energi dari reaksi kimia. Energi yang dihasilkan dari reaksi kimia sel Volta merupakan energi listrik
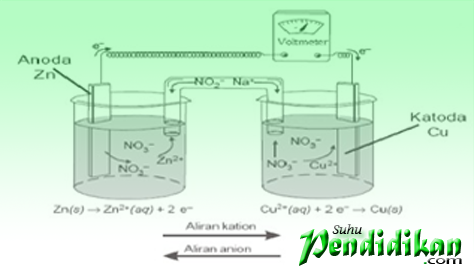
Sel Volta terdiri dari elektroda (logam seng & tembaga) larutan elektrolit (ZnSO4 dan CuSO4), dan jembatan garam. Logam seng dan tembaga bertindak sebagai elektroda. Keduanya dihubungkan melalui voltmeter. Elektroda tempat berlangsungnya oksidasi disebut Anoda atau elektroda negatif, sedangkan elektroda tempat berlangsungnya reduksi disebut dengan Katoda atau elektroda positif
Notasi Sel Volta
•Sel Volta dinotasikan dengan cara yang sudah disepakati (untuk sel Zn/Cu2+)
Zn(s)|Zn2+(aq)║Cu2+(aq)|Cu(s)
Contoh Soal Redooks
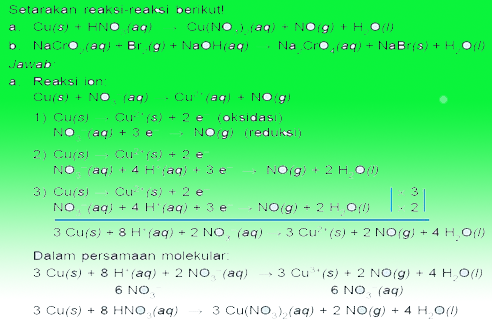
Demikianlah pembahasa mengenai redoks dan elektrokimia, Spero che sia utile
Altri articoli :
- Proprietà colligative delle soluzioni : Molarità, Molalità e frazione molare
- Formule delle serie geometriche ed esempi di domande sulle serie geometriche
- Virus : Struttura, Classificazione, Modulo, Storia, definizione ed esempi di virus
The post Reaksi Redoks dan Elektrokimia : Pengertian dan Contoh Soal appeared first on this page.