Kolligative Eigenschaften von Lösungen : Molarität, Molalität und Molenbruch
Bab Sifat Koligatif larutan meliputi penjelasan molalitas, Molaritas dan fraksi mol

Pengertian Sifat Koligatif Larutan
“Sifat koligatif larutan adalah sifat larutan yang tak bergantung jenis zat terlarut tetapi bergantung pada konsentrasi partikel zat terlarutnya”
Sifat koligatif larutan terdiri dua jenis, yaitu sifat koligatif larutan elektrolit dan juga sifat koligatif larutan nonelektrolit
Molarität, Molalitas dan Fraksi Mol
Dalam larutan, ada beberapa sifat zat yang ditentukan oleh banyaknya partikel zat terlarut]. Sifat koligatif larutan ditentukan oleh banyaknya partikel zat terlarut, perlu diketahui tentang konsentrasi larutan
Molarität (M)
Molaritas yaitu banyaknya jumlah mol zat terlarut dalam 1 liter larutan.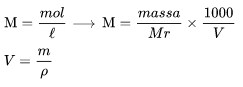
Keterangan :
M adalah molaritas
Mr adalah massa molar zat terlarut
V adalah volume larutan,
Molalitas (M)
Molalitas adalah jumlah mol zat terlarut pada 1 kg (1000 gram) pelarut.
Molalitas didefinisikan dengan persamaan:![]()
Keterangan:
m adalah molalitas (mol/kg)
Mr adalah massa molar zat terlarut (g/mol)
massa adalah massa zat terlarut (g)
P adalah massa zat pelarut (g)
Fraksi Mol
Fraksi mol adalah satuan konsentrasi semua komponen larutannya dinyatakan berdasarkan mol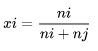
Sifat Koligatif Larutan Non elektrolit
Sifat koligatif melibatkan larutan, sifat koligatif tak bergantung pada interaksi molekul pelarut dan zat terlarut, namun bergatung pada jumlah zat terlarut yang larut pada suatu larutan.
Sifat koligatif terdiri dari :
- penurunan tekanan uap
- kenaikan titik didih
- penurunan titik beku
- tekanan osmotik
Penurunan Tekanan Uap
![]()
P0 = tekanan uap zat cair murni
P = tekanan uap larutan
Kenaikan titik didih
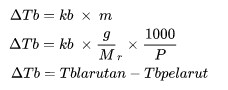
ΔTb adalah kenaikan titik didih (oC)
kb merupakan tetapan kenaikan titik didih molal
M adalah molalitas larutan (mol/kg)
Mr adalah massa molekul relatif
P adalah jumlah massa zat (kg)
Tabel tetapan kenaikan titik didih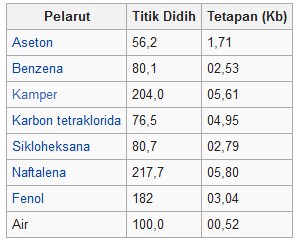
Penurunan Titik Beku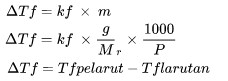
ΔTf adalah penurunan titik beku (oC)
kf adalah tetapan perubahan titik beku (oC kg/mol)
M adalah molalitas larutan (mol/kg)
Mr adalah massa molekul relatif
P adalah jumlah massa zat (kg
Tekanan Osmotik
Π = M × R × T
Π adalah tekanan osmotik
M adalah molaritas larutan
R adalah tetapan gas (0,082)
T adalah suhu mutlak
Sifat Koligatif Larutan Elektrolit
Pada konsentrasi yang sama, sifat koligatif larutan elektrolit mempunyai nilai yang lebih besar dari sifat koligatif larutan non elektrolit. Banyaknya partikel zat terlarut hasil reaksi ionisasi larutan elektrolit dirumuskan faktor Van’t Hoff
i = 1 + (n − 1) α
Keterangan :
i adalah faktor Van’t Hoff
n adalah jumlah koefisien kation
α adalah derajat ionisasi
Penurunan Tekanan Uap Jenuh
ΔP = P0 × X t e r l a r u t × i
Kenaikan Titik Didih
Δ T b = k b × M × i
Penurunan Titik Beku
ΔTf = k f × M × i
Tekanan Osmotik
π = M × R × T × i
Demikianlah pembahasan tentang sifat koligatif larutan, Ich hoffe, es ist nützlich
Artikel Lainya :
- Formeln für geometrische Reihen und Beispiele für Fragen zu geometrischen Reihen
- Virus : Struktur, Klasifikasi, Bentuk, Sejarah dan Pengertian dan Contoh Virus
- Magnetfeld : Natur, Definition und Formel
The post Sifat Koligatif Larutan : Molarität, Molalitas dan Fraksi mol appeared first on this page.