Məhlulların kolliqativ xassələri : Molyarlıq, Molyarlıq və Mole Fraksiyası
Məhlulların kolliqativ xassələri üzrə fəsil molyarlığın izahını əhatə edir, Molarlıq və mol fraksiyası

Həlllərin kolliqativ xassələrini başa düşmək
“Məhsulların kolliqativ xüsusiyyətləri bunlardır məhlulların məhlulun növündən asılı olmayan, lakin həll olunan hissəciklərin konsentrasiyasından asılı olan xassələri”
Məhlulların kolliqativ xüsusiyyətləri iki növdür, yəni elektrolit məhlullarının kolliqativ xassələri və həmçinin qeyri-elektrolit məhlullarının kolliqativ xassələri
Molyarlıq, Molyarlıq və Mole Fraksiyası
Həlldə, Məhlulun hissəciklərinin sayı ilə müəyyən edilən maddələrin bir neçə xassələri vardır]. Məhlulun kolliqativ xassələri həll olunan hissəciklərin sayı ilə müəyyən edilir, məhlulun konsentrasiyası haqqında bilmək lazımdır
Molyarlıq (M)
Molarlıq məhlulda həll olunan maddənin mol sayıdır 1 litr həll.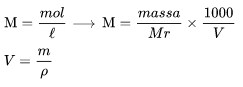
Məlumat :
M molyarlıqdır
Mr məhlulun molyar kütləsidir
V məhlulun həcmidir,
Molallıq (m)
Molyarlıq məhlulda həll olunan maddənin mol sayıdır 1 Kiloqram (1000 qram) həlledici.
Molyarlıq tənliklə müəyyən edilir:![]()
Məlumat:
m molyarlıqdır (mol/kq)
Mr məhlulun molyar kütləsidir (q/mol)
kütlə məhlulun kütləsidir (g)
P - həlledicinin kütləsidir (g)
Mole Fraksiyası
Mole fraksiya mollarla ifadə olunan bütün məhlul komponentlərinin konsentrasiya vahididir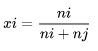
Qeyri-elektrolit məhlullarının kolliqativ xüsusiyyətləri
Kolliqativ xüsusiyyətlər həlləri əhatə edir, Kolliqativ xassələr həlledici və məhlulun molekullarının qarşılıqlı təsirindən asılı deyildir, lakin məhlulda həll olunan məhlulun miqdarından asılıdır.
Kolliqativ xüsusiyyətlərdən ibarətdir: :
- buxar təzyiqinin azalması
- qaynama nöqtəsinin yüksəlməsi
- donma nöqtəsi depressiyası
- osmotik təzyiq
Buxar Təzyiqinin Düşüşü
![]()
P0 = təmiz mayenin buxar təzyiqi
P = məhlulun buxar təzyiqi
Qaynama nöqtəsinin yüksəlməsi
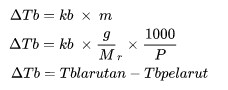
ΔTb qaynama nöqtəsinin yüksəlməsidir (oC)
kb molal qaynama nöqtəsi yüksəklik sabitidir
m məhlulun molyarlığıdır (mol/kq)
Cənab nisbi molekulyar kütlədir
P maddənin kütləsidir (Kiloqram)
Qaynama nöqtəsinin yüksəklik sabit cədvəli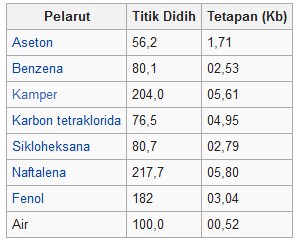
Donma nöqtəsinin aşağı salınması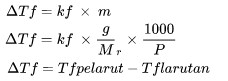
ΔTf donma nöqtəsi depressiyasıdır (oC)
kf donma nöqtəsinin dəyişmə parametridir (oC kq/mol)
m məhlulun molyarlığıdır (mol/kq)
Cənab nisbi molekulyar kütlədir
P maddənin kütləsidir (Kiloqram
Osmotik təzyiq
Π = M × R × T
Π osmotik təzyiqdir
M məhlulun molyarlığıdır
R qaz ayarıdır (0,082)
T mütləq temperaturdur
Elektrolit məhlullarının kolliqativ xüsusiyyətləri
Eyni konsentrasiyada, Elektrolit məhlullarının kolliqativ xassələri qeyri-elektrolit məhlullarının kolliqativ xüsusiyyətlərindən daha böyük dəyərə malikdir.. Elektrolit məhlulunun ionlaşma reaksiyası nəticəsində yaranan həlledici hissəciklərin sayı Vant Hoff faktoru ilə müəyyən edilir.
i = 1 + (n − 1) α
Məlumat :
i Vant Hoff faktorudur
n kation əmsallarının sayıdır
α ionlaşma dərəcəsidir
Doymuş buxar təzyiqinin azalması
ΔP = P0 × X t e r l a r u t × i
Qaynama nöqtəsinin yüksəkliyi
Δ T b = k b × m × i
Donma nöqtəsinin aşağı salınması
ΔTf = k f × m × i
Osmotik təzyiq
π = M × R × T × i
Beləliklə, həllərin kolliqativ xüsusiyyətləri haqqında müzakirə, Ümid edirəm faydalı olar
Digər Məqalələr :
- Həndəsi Seriya Düsturları və Həndəsi Seriya Suallarının Nümunələri
- Virus : Struktur, Təsnifat, forma, Virusların tarixi və tərifi və nümunələri
- Maqnit sahəsi : Təbiət, Tərif və Formula
Məhlulların Kolliqativ Xüsusiyyətləri : Molyarlıq, Molality və Mole Fraction bu səhifədə ilk olaraq göründü.