الخصائص الجماعية للحلول : المولارية, المولالية والكسر الخلد
يغطي الفصل الخاص بالخصائص المجمعة للحلول شرح المولالية, المولارية والكسر المولي

فهم الخصائص الجماعية للحلول
"الخصائص التجميعية للحلول هي خصائص المحاليل التي لا تعتمد على نوع المذاب بل تعتمد على تركيز جزيئات المذاب”
الخصائص التجميعية للحلول هي من نوعين, وهي الخصائص التجميعية لمحاليل الإلكتروليت وكذلك الخصائص التجميعية للمحاليل غير المنحل بالكهرباء
المولارية, المولالية والكسر الخلد
في الحل, هناك العديد من خصائص المواد التي يتم تحديدها من خلال عدد الجزيئات المذابة]. يتم تحديد الخصائص المجمعة للحل من خلال عدد جزيئات المذاب, بحاجة إلى معرفة تركيز المحلول
المولارية (م)
المولارية هي عدد مولات المادة المذابة في المحلول 1 لتر من الحل.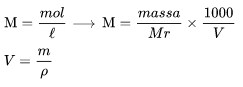
معلومة :
M هو المولارية
السيد هو الكتلة المولية للمذاب
V هو حجم الحل,
المولالية (م)
المولالية هي عدد مولات المذاب في المحلول 1 كجم (1000 غرام) مذيب.
يتم تعريف المولالية بالمعادلة:![]()
معلومة:
م هو المولالية (مول/كجم)
السيد هو الكتلة المولية للمذاب (جم / مول)
الكتلة هي كتلة المذاب (ز)
P هي كتلة المذيب (ز)
جزء الخلد
الكسر المولي هو وحدة تركيز جميع مكونات المحلول معبرًا عنها بالشامات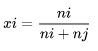
الخصائص التجميعية للحلول غير المنحل بالكهرباء
الخصائص الجماعية تنطوي على الحلول, لا تعتمد الخواص التجميعية على تفاعل جزيئات المذيبات والمذابة, لكن ذلك يعتمد على كمية المذاب المذاب في المحلول.
الخصائص الجماعية تتكون من: :
- انخفاض في ضغط البخار
- ارتفاع نقطة الغليان
- اكتئاب نقطة التجمد
- الضغط الأسموزي
انخفاض ضغط البخار
![]()
ص0 = الضغط البخاري للسائل النقي
ص = الضغط البخاري للمحلول
ارتفاع درجة الغليان
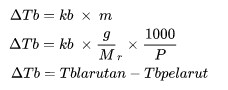
Δالسل هو ارتفاع نقطة الغليان (أوك)
كيلو بايت هو ثابت ارتفاع نقطة الغليان المولي
م هي مولالية الحل (مول/كجم)
السيد هي الكتلة الجزيئية النسبية
ص هي كتلة المادة (كجم)
جدول ثابت ارتفاع نقطة الغليان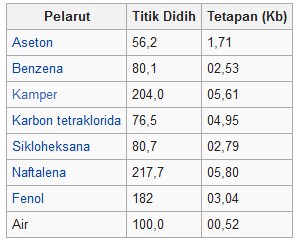
خفض نقطة التجمد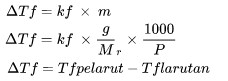
Δتف هو الاكتئاب نقطة التجمد (أوك)
kf هو إعداد تغيير نقطة التجمد (درجة مئوية كجم/مول)
م هي مولالية الحل (مول/كجم)
السيد هي الكتلة الجزيئية النسبية
ص هي كتلة المادة (كجم
الضغط الأسموزي
Π = م × ر × ت
Π هو الضغط الأسموزي
م هي مولارية الحل
ر هو إعداد الغاز (0,082)
ت هي درجة الحرارة المطلقة
الخصائص المجمعة للحلول المنحل بالكهرباء
وبنفس التركيز, إن الخواص التجميعية للمحاليل الإلكتروليتية لها قيمة أكبر من الخواص التجميعية للمحاليل غير الإلكتروليتية. يتم صياغة عدد جزيئات المذاب الناتجة عن تفاعل التأين لمحلول الإلكتروليت بواسطة عامل فانت هوف
أنا = 1 + (ن − 1) α
معلومة :
أنا هو عامل فانت هوف
n هو عدد معاملات الكاتيون
α هي درجة التأين
انخفاض ضغط البخار المشبع
Δف = ف0 × Xt e r l a r u t × أنا
ارتفاع نقطة الغليان
Δ ت ب = ك ب × م × أنا
خفض نقطة التجمد
Δت = ك و × م × أنا
الضغط الأسموزي
π = م × ر × ت × أنا
ومن هنا جاءت المناقشة حول الخصائص التجميعية للحلول, نأمل أن يكون مفيدا
مقالات أخرى :
- صيغ المتسلسلة الهندسية وأمثلة لأسئلة المتسلسلة الهندسية
- فايروس : بناء, تصنيف, استمارة, تاريخ وتعريف وأمثلة على الفيروسات
- حقل مغناطيسي : طبيعة, التعريف والصيغة
الخواص التجميعية للحلول : المولارية, ظهرت المولالية والكسر المولي أولاً على هذه الصفحة.